Oxidatie
De meeste metalen karakteriseren zich door hun stabiliteit en sterkte en zijn daarom de perfecte materialen voor constructies die enorme krachten moeten weerstaan.
Maar ijzer en staal hebben een verborgen vijand, die over de tijd heen vernietiging optreedt. Het is de zuurstof in onze atmosfeer. Sinds de mens begonnen is met het gebruiken van metalen wordt men geteisterd door roest.

Corrosie van metalen
Een bruine spijker in een gereedschapskist, of groen uitgeslagen koperen munten; roest ofwel corrosie kennen we in vele vormen.
In dit artikel vind je een uiteenzetting over het ontstaan en de gevolgen van roest bij verschillende materialen. Dit artikel omvat door Tosec bewerkbare metalen die zonder de juiste aanpak onderhevig kunnen zijn aan roestvorming, zoals staal, aluminium en RVS. Daarnaast komen een aantal andere metaalsoorten aan bod met eveneens interessante vormen van roest of oxidatie.
Wat is roest?
Roest is één van de meest bekende vormen van corrosie.
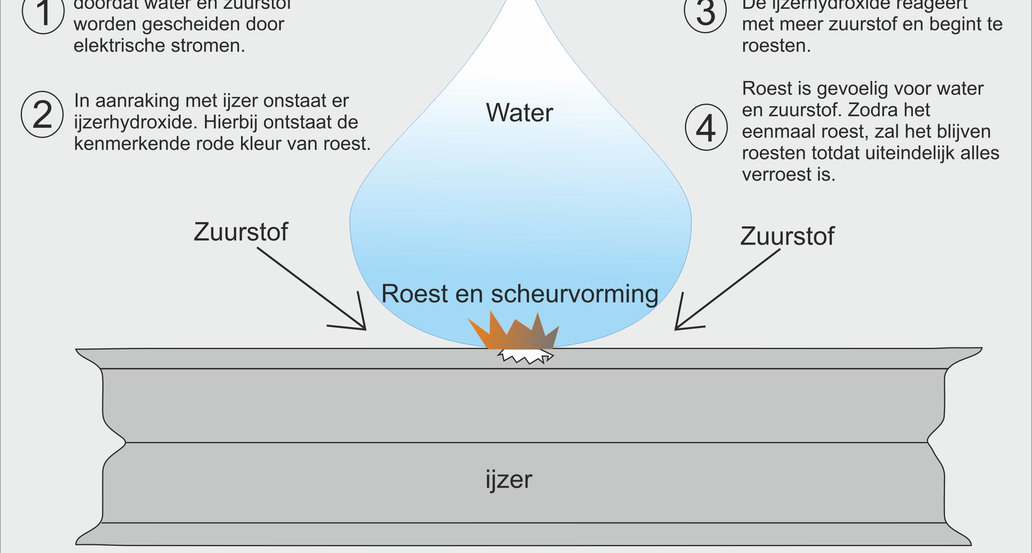
Roest is aantasting van metaal doordat het reageert op een combinatie van water en zuurstof. In het geval van ijzer ontstaat er dan ijzeroxide. Daarom wordt roesten ook vaak oxideren genoemd. Roest wordt doorgaans als negatief effect op metaal ervaren, omdat het de sterkte en het volume van metaal beïnvloed. Daarnaast ontstaat er door de verbinding met zuurstof een ongewenste verkleuring van het metaal.
Wat is het verschil tussen corrosie en roest?
Corrosie is de overkoepelende benaming van het aantasten van materiaal, door reactie met hun omgeving. In het geval van ijzer ontstaat roest als gevolg van de aanraking met water en zuurstof (oxide, ook wel oxidatie). Met roesten wordt dus specifiek het oxideren van ijzer of staal bedoeld, wat een vorm van corrosie is.
Hoe ontstaat roest?
In het geval van staal treedt oxidatie op wanneer staal of een ander materiaal met een legering van ijzer, wordt blootgesteld aan zuurstof en water.
Na verloop van tijd zullen zuurstof en ijzer zich op atomair niveau gaan hechten. Hierdoor ontstaat een nieuwe verbinding genaamd ijzeroxide. Water versnelt het gehele proces doordat het een uitstekende katalysator is. Kleine watermoleculen dringen door in het metaal en vormen nog meer zuren, waardoor metaal nog meer wordt blootgesteld aan oxidevorming. In het geval van zeewater zal ijzer nog veel sneller roesten, vanwege het zout dat als geleider dient.
Welke verschijnselen zijn zichtbaar tijdens het roestproces?
Staal (ijzer)
Kenmerkend voor het oxideren van of staal is de bruinrode kleur die ontstaat. Doordat tijdens het roesten het volume toeneemt worden bestaande constructies uit elkaar gedrukt. Constructies kunnen hierdoor gaan scheuren waardoor deze verzwakt worden. Het verroeste staal zal op den duur dermate diep verroest zijn, dat deze zal afschilferen. Over de tijd heen kunnen zodoende complete constructie uiteindelijk wegvreten worden. In de bouw is het verroesten van betonstaal een groot probleem. Indien het betonijzer in gewapend beton gaat roesten, scheurt het beton en neemt in sterkte af. Dit wordt betonrot genoemd.
Koper
Wanneer koper in aanraking komt met water en zuurstof (H2O), zal koper groen uitslaan.
Hierbij ontstaat het mineraal Malachiet. Tevens kan koper zwart uitslaan (koperoxide). In sommige gevallen wordt het groen uitslaan van koper juist opgewekt. De corrosielaag, die in deze vorm patina wordt genoemd, is onder andere herkenbaar op kunstobjecten, zoals het vrijheidsbeeld in New York.
Tosec verwerkt geen koper.
Staal
Omdat staal een legering is van ijzer en koolstof, zijn de verschijnselen die optreden bij oxidatie vergelijkbaar met dat van ijzer.
Het roesten van staal hoeft niet direct nadelig te zijn. Door het creëren van een oxidelaag om staal heen, wordt de binnenste structuur beschermt tegen zuurstof, wat het oxidatieproces sterk vertraagt. Dit type staal wordt ook wel Cortenstaal genoemd en kent vele toepassingen in constructies, offshore, kunst en als zeecontainers.
Aluminium
Van aluminium is bekend dat het van nature corrosiebestendig is.
Aluminium oxideert echter nog sneller dan ijzer. Het verschil zit in het feit dat roest een ijzerconstructie verzwakt. Aluminiumoxide vormt echter een geheel met het aluminium zelf. Het vormt een dichte, ondoordringbaar oppervlak. Deze laag is in principe zo dicht dat er geen zuurstofmoleculen doorheen dringen en daarmee het oxidatieproces stopt als de laag volledig dekkens is. Er is geen behandeling hiervoor nodig. Nadeel is dat chloor moleculen wel door de oxide laag heen kunnen dringen. Zoute omstandigheden, zoals strooizout in de winter, zorgen ervoor dat aluminium toch kan blijven oxideren. De checmische benaming van zout is natriumchloride en bevat dus chloriden.
Edelmetalen zoals goud en zilver
Edelmetalen zullen veel minder snel oxideren dan de hierboven genoemde metalen.
Toch zijn deze metalen wel vatbaar voor oxidatie. Zilver kan reageren met stoffen zoals zwavel en zal dan zwart uitslaan. Gouden juwelen bestaan voor een klein deel uit andere metalen zoals koper of nikkel om het te verstevigen. Deze metalen zijn gevoelig voor oxidatie en zorgen voor de verkleuring in goud. Puur oud reageert nauwelijks met andere elementen en zal dus niet eenvoudig oxideren. Goud wordt dan ook wel als dunne opgedampte laag gebruikt om oxidatie te voorkomen. Bijvoorbeeld in elektrische contacten in computers, audio apparatuur en meetapparatuur.
Heeft u vragen? Neem gerust contact met ons op, wij staan voor u klaar
Nadelen van roest
Het roesten van ijzer en staal heeft een nadelig karakter voor het materiaal zelf.
Roest heeft een grotere volume dan het originele materiaal en zal gaan uitzetten en het originele materiaal langzaam uit elkaar drukken. Het vormt om deze reden een groot risico voor constructies zoals bruggen en kranen.
Edelmetalen die veelal gebruikt worden in sierraden en juwelen, zijn vaak van nature beter beschermd tegen corrosie. Puur goud en zilver zullen uit zichzelf niet oxideren door lucht of omgeving. Door aanraking met zwavel zal zilver echter zwart en dof worden. Goud zal, afhankelijk van het materiaal wat er in vermengd is, ook van kleur veranderen. Dit beïnvloedt de cosmetische waarde van deze edelmetalen aanzienlijk.
Het Oxidatieproces kent zowel economische als veiligheidsrisico’s. Een voorbeeld hiervan is het roesten van een brug, waardoor de constructie ernstig verzwakt. Dit vormt een veiligheidsrisico. Het roestende deel zal hersteld moeten worden, dit vormt het economische risico. Het sterkteverlies ontstaat doordat de bronnen van oxidatie, zoals oxide en zout, zwakker zijn dan het metaal zelf. Hierdoor brokkelen ze langzaam af waardoor het originele materiaal dunner wordt en er zelfs gaten kunnen ontstaan in het metaal. In de jaren '80 en '90 was roest veelvuldig terug te vinden in de chassis en carroseriedelen van auto's. Vele auto's niet meer door de APK gekomen doordat het onderstel volledig was doorgeroest.
Hoe is roest te voorkomen?
De meest gehanteerde manier om roest en corrosie te voorkomen is door het originele metaal te beschermen van invloeden van buitenaf.
Er wordt een beschermende laag gecreëerd om het metaal heen. Dit gebeurt met de volgende technieken:
Een beschermende verf of laklaag om het metaal heen. Het voordeel hiervan is dat je het metaal direct in de gewenste kleur kunt verven.
Een laag zink toevoegen over het metaal zelf. Onze pagina over verzinken geeft een uitgebreide beschrijving van dit proces.
Dit gebeurt bij het corrosiebestendig maken van aluminium. Door een elektrolytisch proces wordt het aluminium omhuld door aluminiumoxide.
Legering van ijzer met chroom, nikkel en koolstof. Het chroom vormt een oxidelaag dat weerstand biedt tegen corrosie. Roestvast staal is niet altijd ongevoelig voor roest. Afhankelijk van de omgeving kunnen er daarom andere materialen zoals molybdeen worden toegevoegd.
Naast deze technieken helpen de volgende aandachtspunten ook bij het voorkomen van roest en corrosie:
- Gaten en spleten kunnen zorgen voor vochtophoping. Daarnaast beïnvloedt dit het corrosiebestendig maken van het materiaal. Denk hierbij ook aan de lasnaden.
- Isoleer verschillende metalen van elkaar. Corrosie kan ook optreden doordat metalen dit aan elkaar overgeven (contactcorrosie).
- Zorg voor goed onderhoud van het metaal. Water en vocht is een belangrijke veroorzaker van corrosie omdat het oxiderende materialen met zich mee kan brengen.
- Creëer zelf een luchtdichte laag om metalen. Door het bijvoorbeeld in te vetten met vaseline of olie, zoals ook vaak bij schaatsen en fietsenkettingen gedaan wordt.
- Het inzetten van luchtontvochtigers om materialen te beschermen tegen vocht en condens, belangrijke aanjagers van corrosie.